在癌症治療上,化療、標靶療法都具有延長壽命作用,但一段時間用藥後會出現抗藥性,因此免疫檢查點抑制劑(ICIs)的應用崛起,曾被視為改寫命運的里程碑,少數病人出現長期緩解,甚至被視為「有機會根治」,但現實是殘酷,「傳統醫療上,很多病人走到最後一線用藥後,就什麼都沒有效。」而能真正達到「根治」機會大概低於 25%左右。
生華科在做的,就是把癌症的治癒率提高,藉由「AI 賦能」與「次世代免疫療法關鍵機轉」,讓生華科 (6492-TW) 站上國際兆元癌症免疫治療的主要關鍵位置,挑戰成為全球生技業的頂尖企業,就如同現在科技產業最具影響力的輝達。
生華科的創立是董事長胡定吾懷抱著對人類的一個巨大願景:「希望結合科技與醫學,根除癌症為不治之症! 」明知很困難仍勇於創新堅持前行,生華科創立迄今透過在全球跨國界、跨科別、跨制度法規下,經由生醫界頂尖科學家一次次嚴謹縝密的臨床應證,確認開發中的兩項創新藥物對於多種癌症治療皆具市 場首見的新穎機轉及有效延長成病人生命的積極臨床效益。從精準醫療跨入免疫療法最核心、也是最困難的一段:生華科矢志讓更多病患從治療「無效」變成「有效」,從短暫控制走向長期存活,使病患活得有品質有尊嚴。
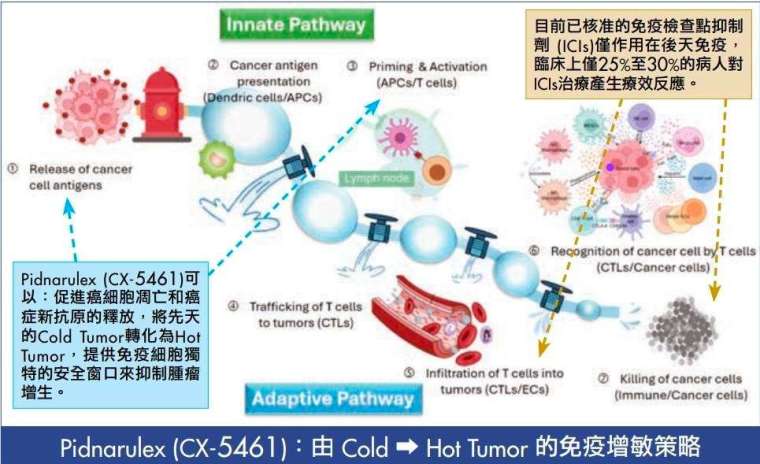
什麼是讓冷腫瘤變熱,從國際大藥廠嬌生公司延攬至生華科出任醫務長的黃品諺醫師用一個生動比喻描述:「腫瘤就像外星人在地球建立殖民地,它改變土 壤、空氣、水,把環境改到免疫細胞進不去。」當免疫細胞進不了腫瘤、腫瘤內缺乏作戰部隊,這種狀態被稱為「冷腫瘤」。冷腫瘤往往對免疫檢查點藥物反應不佳,但就算是「最熱」的腫瘤類型,若缺乏精準的抗原呈現引導,免疫部隊進去後也容易迷失方向或被癌細胞偽裝欺騙,導致臨床反應率仍有限。
因此,要突破免疫療法瓶頸,關鍵在「改變腫瘤微 環境」,把冷腫瘤變熱,更重要的是,如何在不犧牲病人的耐受性與擁有生活品質下達成。黃品諺醫師 說,現行常見的很多合併療法失敗,是因為一邊想把環境加熱,一邊又把免疫細胞殺光了,化療可能讓免疫系統還沒來得及建立「記憶」,就先被打垮了。
生華科在做的是「免疫記憶」,如果病人達到根治,就要是讓體內的免疫細胞繼續巡邏,只要癌細胞再出現,就能再次獵殺它,而這就是根治的科學基礎。這也正是生華科藥物切入的戰場 : 不只要讓腫瘤變熱,還要讓免疫系統具備精準獵殺的導航與記憶力。
生華科目前受到全球生醫界關注的,是兩個不同機制的市場首見新藥:CX-4945 與 CX-5461 就是癌症治療至為重要的兩把鑰匙,CX-4945 是罕見但關鍵的 CK2 靶點,可精準抑制癌細胞複製路徑,CX-5461 則是領先全球臨床進度的 G-quadruplex 穩定劑,根據最新臨床顯示二大藥物非常有潛力攻克癌症。
2024 年諾貝爾化學獎頒發給 Google AI DeepMind 團隊的 Demis Hassabis 和 John Jumper,獲獎原因 : 他們運用 AI 模型 AlphaFold 2,準確預測蛋白質三維 結構,實現了科學家努力五十多年的夢想。諾貝爾獎官網敘明:「沒有蛋白質,生命就無法存在。」人類現在可以預測蛋白質結構並且自己設計全新的蛋白 質,可望協助癌症免疫疾病治療策略開發、預測蛋白質與其他生物分子複合物、蛋白質與小分子配體交互作用、協助小分子藥物與疫苗開發、加快醫學研究進程,挽救生命與改善人類生活、有益環境與環保及其他生物材料研發。
Google DeepMind 與耶魯實驗雙重驗證 生華科 CX-4945 啟動人體免疫開關
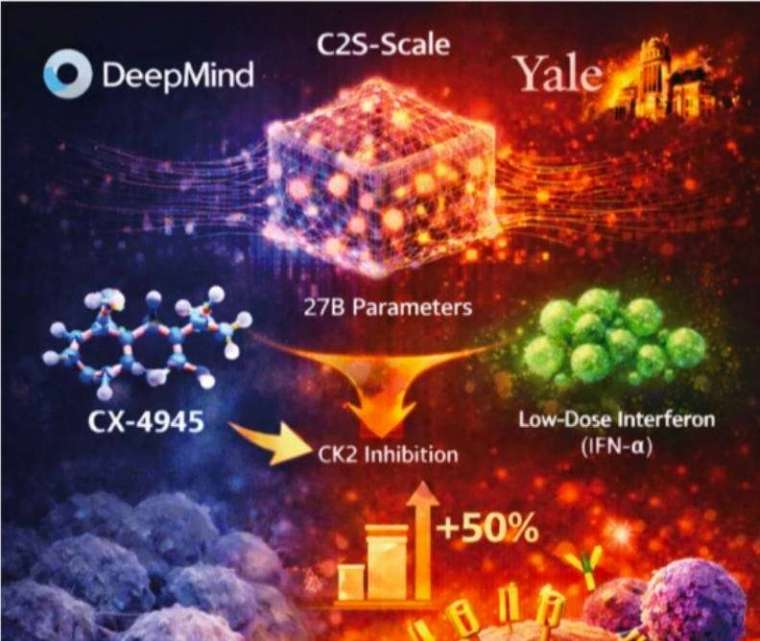
2025 年 Google AI DeepMind 團隊與耶魯大學臨床實驗首次發現並確認生華科新藥 CX-4945 可廣泛使用於癌症免疫治療中,Google 執行長 Sundar Pichai 更在 X (原推特) 興奮的發文 : AI 在科學領域有一個令人振奮的里程碑,發現一條開發抗癌療法的新途徑。
Google DeepMind 的 Al 模型研究指出 CX-4945 具有全新抗癌潛力。這項由「AI 背書」對生華科的實質戰略意義在於,模型從逾 4,000 種藥物中點名 CX-4945 可選擇性強化抗原呈現、將冷腫瘤變熱腫瘤,體外實驗已驗證此路徑,讓 CX-4945 躍升為「AI 世代的新一代免疫檢查點抑制劑(ICIs)組合骨幹候選藥物」。
而在 Google DeepMind 的 Al 模型研究公布後,加速了生華科與各大國際藥廠的授權談判,DeepMind 與耶魯大學合作,運用擁有 270 億參數的單細胞分析模 型 C2S-Scale,預測 CX-4945 透過抑制激酶 CK2,可促進 MHC-I 表現並強化免疫辨識能力。更重要的是臨床驗證,當腫瘤細胞同時接受 CX-4945 與低劑量干擾素處理時,抗原呈現能力提升約 50%,讓腫瘤細胞更容易被免疫系統辨識,突破長期以來「冷腫瘤」無法被免疫治療攻擊的瓶頸。
CX-4945 被稱為「冷腫瘤轉熱」的關鍵,更是首個臨床開發中 CK2 抑制劑,具備免疫調控與參與 DNA 複製調控多重作用。另外,還可與現行療法的化療聯合使用。臨床數據上,在膽管癌與皮膚癌皆展現早期療效的 Strong Trending,更是全球開發進程領先的 CK2 抑制劑,具多重適應症潛力與聯合治療價值。
其中,CK2 是一個參與多種病態路徑的關鍵節點,牽涉腫瘤增生、轉移、DNA 修復與抗藥性。CX-4945 在全球同類中具稀缺性,並且已推進至臨床二期開發 階段。而讓 4945 近來能見度急速攀升的,還有一條跨界線索:AI 模型對藥物合併策略的指向。過去國際上不少業界都曾與「用超級電腦預測藥物」的新創合作,最後常卡在毒性、吸收、或無法進入臨床,但這次 Google DeepMind 的 Al 模型與耶魯大學臨床實驗指向的,是一個已有人體臨床安全性資料,且運用海量數據與不同方法演算都指向同一結論。
生華科執副暨財務長張小萍共同指出,CX-4945 除了具備「廣譜性」抗癌潛力,其抑制 CK2 可降低巨噬細胞中的 NF-κB 活性,具有高度潛力可應用於癌症外的自體免疫疾病、病毒感染,已具備對外授權與全球布局的潛力。

另外,現在 CX-4945 於臨床試驗,已完成膽管癌、基底細胞癌,積極開展授權活動,持續收案中為收治多種難治型兒童腫瘤試驗包括,神經母細胞瘤、伊文 氏肉瘤等,期望在兒童癌症治療領域帶來突破。
CX-4945 在膽管癌、皮膚癌、兒童腫瘤等領域已累積 Phase I/II 安全性與初步療效資料,並在小兒腦瘤中拿到罕見病的 Fast Track,相關的 PRV 憑證具備極 高市場價值,未來更可強化 CX-4945 作為「Combo Therapy(組合療法)」必備組件的市場地位。
談到 CX-5461,黃品諺醫師強調,「我們最重要的 特色之一,是低骨髓毒性。」原因很直接:免疫療法要成功,得靠免疫細胞活下來、學會辨識、形成記憶;如果藥物本身會讓白血球大幅下降,不只免疫反應做不起來,病人也可能因感染付出代價。
CX-5461 從 DNA 層級打開上游「召喚系統」 建立免疫記憶地基
CX-5461 的機制核心,為目前全球臨床開發最領先的 G4 穩定劑,亦為首個獲得美國 FDA 孤兒藥與 Fast Track 資格的創新機轉藥物,具 First-in-Class 及重磅藥物商業化潛力。另外,更獲選 NCI(美國)重要開發藥物,已有四項試驗開展中,為全台首見。
更重要的是 CX-5461 可促使腫瘤產生新抗原、誘發免疫反應:「腫瘤細胞凋亡時會釋放抗原,啟動樹突細胞,像指揮官一樣把訊號往下傳,教會特種部隊 (T 細胞)『敵我辨識』。」
另外,最具象徵性的,是與美國國衛院 NIH 的合作案。「NIH 用的是納稅人的錢,申請不只看論文,還會在他們自己的實驗室做許多驗證。」生華科相關計 劃一次有四個案子獲得支持,且在川普政府刪減預算下,仍維持推進,讓不少國際大藥廠和同業直呼不可思議。

CX-5461 被美國 NCI 納入國家 NExT 計畫,多項 NCI 贊助試驗鎖定 MSS 大腸癌 (和賽諾菲 / 再生元的 anti-PD1 合併)、實體腫瘤、高風險血液腫瘤、以及乳癌 (和 阿斯特捷利康 / 第一三共的 ADC 合併),顯示其被視為具潛在高開發價值的 first-in-class G4 stabilizer 抗癌藥物。
此外,CX-5461 已獲美國 FDA Fast Track 認定,適應症為帶有 BRCA1/2、PALB2 等 HRD 相關基因缺損的實體腫瘤,並在 ESMO 等大型國際會議公布具臨床獲益的期中數據。
更重要的是,生華科近期與跨國藥廠 BeOne Medicines 達成臨床合作協議,共同推進一項全球多中心臨床試驗。該試驗將以生華科的市場 CX 5461 合併使用 BeOne Medicines 已上市 PD-1 抑制劑 tislelizumab,評估在治療多項晚期實體腫瘤,包括胰臟癌、免疫檢查點抑制劑抗性黑色素瘤的安全性及治療潛力。此合作協議將使 CX-5461 正式跨入免疫腫瘤治療領域,為臨床佈局與授權潛力帶來關鍵推進,更展現推動策略性組合療法開創新局、突破免疫療法瓶頸,讓全球更多癌症患者受惠的決心,希望透過 CX-5461 活化腫瘤微環境的獨特機制,為患者帶來生命新希望,同時為公司創造國際能見度以及長期的價值趨動與成長動能,並加速商化。
CX-5461 針對「合成致死(Synthetic Lethality)」機轉,在特定基因缺損的的實體腫瘤展現潛在療效。CX-5461 也具次世代 DNA 損傷修復(DDR)藥物的獨特性。從人體臨床實驗進一步觀察到 CX-5461 在製造腫瘤 DNA 複製斷裂的過程中可同時增加 PD-L1 表達與免疫浸潤,為 PARP 後時代與 ICIs 難治族群提供下一代基石療法。
生華科攜手 Cancer Free 實現精準醫療方案
突破傳統「一體適用」轉變為「量身訂製」的個人化精準選擇用藥,已是癌症治療的新趨勢,生華科與精拓生技(CancerFree Biotech)開展合作,運用其開 發「腫瘤分身平台(EVASelect)」,可以精準篩選對生華科 CX-5461 及 CX-4945 兩款新藥具最佳反應的患者族群,以大幅提升臨床試驗成功率、加快新藥開發 進程,並強化全球市場競爭力。
「腫瘤分身平台(EVASelect)」是由台北醫學大學技術移轉開發,具備顛覆性的創新突破。該技術僅需抽取 20cc 血液,即可從患者循環腫瘤細胞(CTC) 中分離並培養出「腫瘤分身」,再多藥同時檢測,協助醫師快速找出最合適的治療策略。這項創新技術目前能培養出 100 種以上癌症模型,已有超過 1,500 名病患測試,其中胰臟癌臨床前檢測準確度接近八成,技術成果獲醫療與產業界高度肯定,更是透過仿生類器官技術,達成「精準醫療」與「個人化精準給藥」的目標。
推動多項國際授權案 2026 年起陸續開花結果
投資人最關心的營收模型,除了藥證取得後的銷售分成,目前的國際臨床授權(Licensing out) 何時能為公司帶來第一波里程碑金(Milestone Payments),也就是短、中、長期的財務獲利路徑。黃品諺醫師、財務長張小萍強調,2026 年起將陸續「開花結果」,財務獲利將更加快速,更明確來講,未來 1∼3 年,生華科將迎來多條關鍵價值重估觸發線,包括 CX-5461 與 CX-4945 多項臨床數據陸續公布、國際藥廠合作深化與潛在新授權案以及於國際學 會與資本市場能見度提升。
根據 Precedence Research 報告,全球癌症免疫療法市場預估將從 2025 年的 1,364 億美元成長至 2034 年的 3,384 億美元,年複合成長率達 10.65%。另據 Grand View Research 預測,至 2030 年,全球免疫療法藥物市場將突破 4,860 億美元。僅管如此,僅有 25%∼30%的病人受益於免疫檢查點藥物治療,各大藥廠無不摩肩擦踵、前仆後繼想要打開潘朵拉的盒子,也就是活化腫瘤免疫微環境。
黃品諺醫師強調,生華科的兩把鑰匙:CX-4945 與 CX-5461,要讓人類看見癌症「根治」的可能性,不是把癌症控制幾年,而是把免疫記憶留在身體裡。也因此,能把免疫療法 25%療效往上推的合併策略,擠進全球最擁擠、也最昂貴的賽道。
生華科的定位,就是在這條賽道上提供「能點燃冷腫瘤」且「不犧牲免疫部隊」的工具,希望的不只是延長幾個月,而是把「能活下來的人」變多。
除了人體臨床實驗,生華科更建立 EAP(恩慈療法)等機制,讓部分迫切需求患者在新藥尚未正式上市前,有更早取得治療選項的可能性;同時也能在有經驗的醫師手上累積真實世界臨床數據。另外,則是導入更精準的收案工具,降低臨床試驗成本、加速數據生成,也就是評估的「腫瘤分身」概念,從血液中取得腫瘤相關材料,在體外建立類器官或模擬系統先行測試敏感性,再更精準地選入可能有效的病人。「晚期病人時間不多,第一次用藥就要更接近答
案。」
跨入全球最熱賽道 做最難最具價值的那一段
張小萍財務長提及生華科願景時強調,「不炫技,談證據;不賣夢,談路徑」,不諱言資源有限,也坦承很多探索需要合作夥伴一起完成,但生華科要的不單是「有效」,而是「更多人能有效」。
生華科 (6492-TW) 是一家以 AI 驗證的新機制、精準臨床平台與國際合作網絡,打造可嵌入多家藥廠管線的長期價值角色的公司。在全球腫瘤免疫治療世代交替的關鍵時刻,生華科正穩步站上新一代「隱形藥王」的起跑線,正式競逐新世代腫瘤免疫兆元賽道,雖然生華科現在於賽道上的結構性位置價值被嚴重低估,「授權落地在即,新授權爆發可期」。生華科誓言要成為生技業的輝達,更要持續創造價值,改寫人類健康新的篇章。
※ 本文經「鉅亨網」授權轉載,原文出處