逸達生技(6576-TW)宣布,旗下前列腺癌新劑型CAMCEVI三個月劑型已通過美國食品藥物管理局(FDA)新藥審查(NDA),後續將由授權夥伴Intas負責商業化,並由Intas的美國特殊製劑子公司Accord BioPharma,負責在美國市場推廣與配送。Accord已啟動J-Code申請,若核發順利,三月劑型預計可在2026年下半年進入主流醫療給付通路,成為公司下一階段成長動能。
公司指出,三月劑型並非單獨運作,而是與既有的六個月劑型一同在美國通路銷售。此雙劑型組合可提供醫師與患者更彈性的治療選項,加速產品導入並提升臨床接受度,策略上有助於提高整體市占率,而非彼此競爭或分食需求。
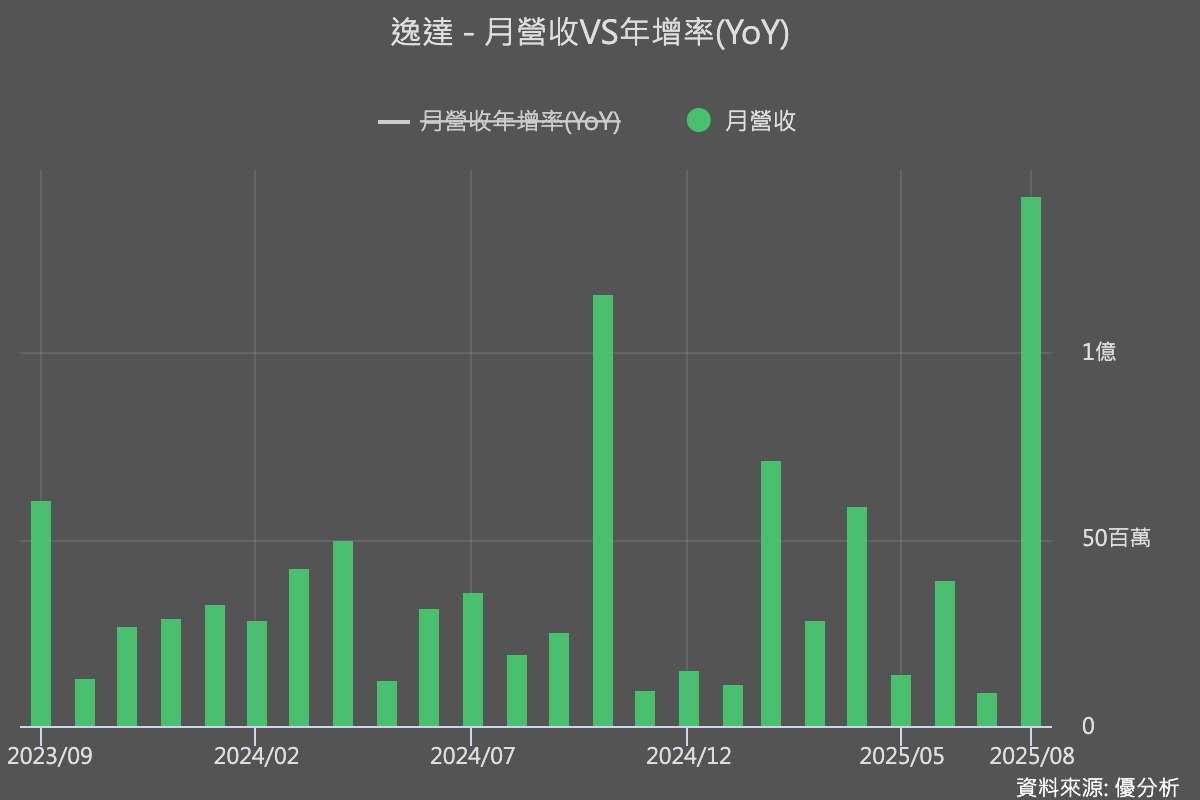
此次核准也帶來短期財務效益,逸達已認列約1.3億元里程金收入,推升八月營收從前一個月的885萬元新台幣顯著跳升至1.4億元。法人認為,這種一次性里程金與六個月劑型的穩定銷售相互搭配,不僅展現商業化的現金轉換能力,也凸顯新劑型對後續成長的延續性。
在供應鏈方面,逸達與夥伴同步進行產能佈局。印度廠區已獲歐盟認證納入全球供應鏈,法國代工廠Fareva則持續升級以符合新版GMP規範。雙基地策略可提升供應彈性、降低單點風險,不過短期內產線改造可能造成出貨節奏延遲。
根據先前公告,FDA已於2025年1月13日發送第74天函(Day 74 Letter),確認審查完成目標日(PDUFA Goal Date)為2025年8月29日。此次於2025年8月26日接獲美國FDA新藥申請審查核可,顯示逸達的三期臨床數據具說服力:共收錄144位患者,主要療效達標率達97.9%,並展現良好的安全性與耐受性。
逸達生物科技股份有限公司是一家跨足台美的生技藥廠,專注於兩大領域:其一是透過獨家長效穩定注射劑型(SIF-LAI)技術開發針劑藥物,其二是針對罕見疾病與嚴重疾病研發創新小分子新藥。旗下核心產品包括治療前列腺癌的CAMCEVI六個月與三個月劑型,六個月劑型已於美國、歐洲及亞洲多國獲准上市;三個月劑型則剛在美國完成審查核准,並計畫進軍歐洲市場。
除此之外,公司亦推進多項臨床管線(Pipeline),例如六個月劑型拓展中樞性性早熟及乳癌適應症,以及針對氣喘、慢性阻塞性肺病、免疫纖維化與罕見遺傳疾病的MMP-12抑制劑和ALDH2活化劑系列藥物,持續朝多元治療領域擴展。