智擎(4162-TW)今日公告,自研新藥 PEP08 已通過澳洲人體試驗倫理審查委員會(HREC)同意,並獲澳洲藥物管理局(TGA)備查,將正式展開第一期針對實體腫瘤的臨床試驗(試驗編號:NCT06973863)。此一進展不僅為研發進度再添里程碑,也為公司在國際腫瘤新藥市場的布局打下基礎。
PEP08 為第二代 PRMT5 抑制劑(蛋白質精氨酸甲基轉移酶5),針對MTAP基因缺失的腫瘤細胞進行選擇性抑制,可望大幅減少對正常細胞的副作用。相較於第一代產品,PEP08精準性更高、安全性更佳,潛在應用範圍橫跨腦癌、胰腺癌、非小細胞肺癌、胃癌與膀胱癌等多種惡性腫瘤。
根據GLOBOCAN 2022統計,全球每年新增約 2,000 萬名癌症患者,其中約 10% 至 15% 帶有 MTAP 基因缺失,推估約有200至300萬名患者屬於PEP08的潛在治療對象,市場機會具高度規模性。特別是腦癌患者中MTAP缺失比例超過40%,顯示 PEP08 在高未滿足醫療需求的癌種中具備切入契機。
本次試驗為 PEP08 的首項人體臨床,預期將收集安全性與初步藥效數據,未來將視結果進一步啟動全球臨床佈局。智擎(4162-TW)持續投入以標靶分子與精準醫療為主軸的創新藥物開發,並透過國際臨床驗證,強化產品線的技術門檻與市場信賴度。
在腫瘤治療日趨個人化與基因導向的趨勢下,智擎(4162-TW)PEP08的研發進展,將是觀察其後續估值重估與策略合作潛力的重要指標。
智擎公司做什麼
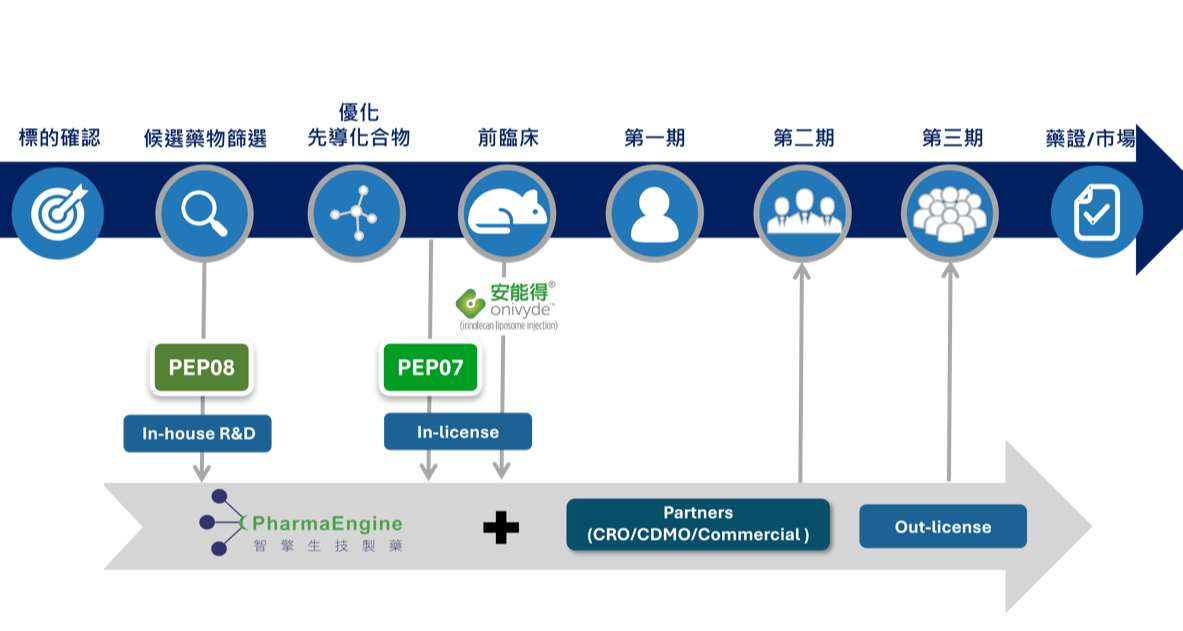
智擎(4162-TW)為東洋集團成員之一,行政院國發會亦為主要法人股東之一,專注於癌症新藥研發,營運模式採取整合型新藥研發模式,授權購買已經過早期研究,較具有成功機會的新藥研發專案,以縮短研發時程,快速導入市場,對外授權。
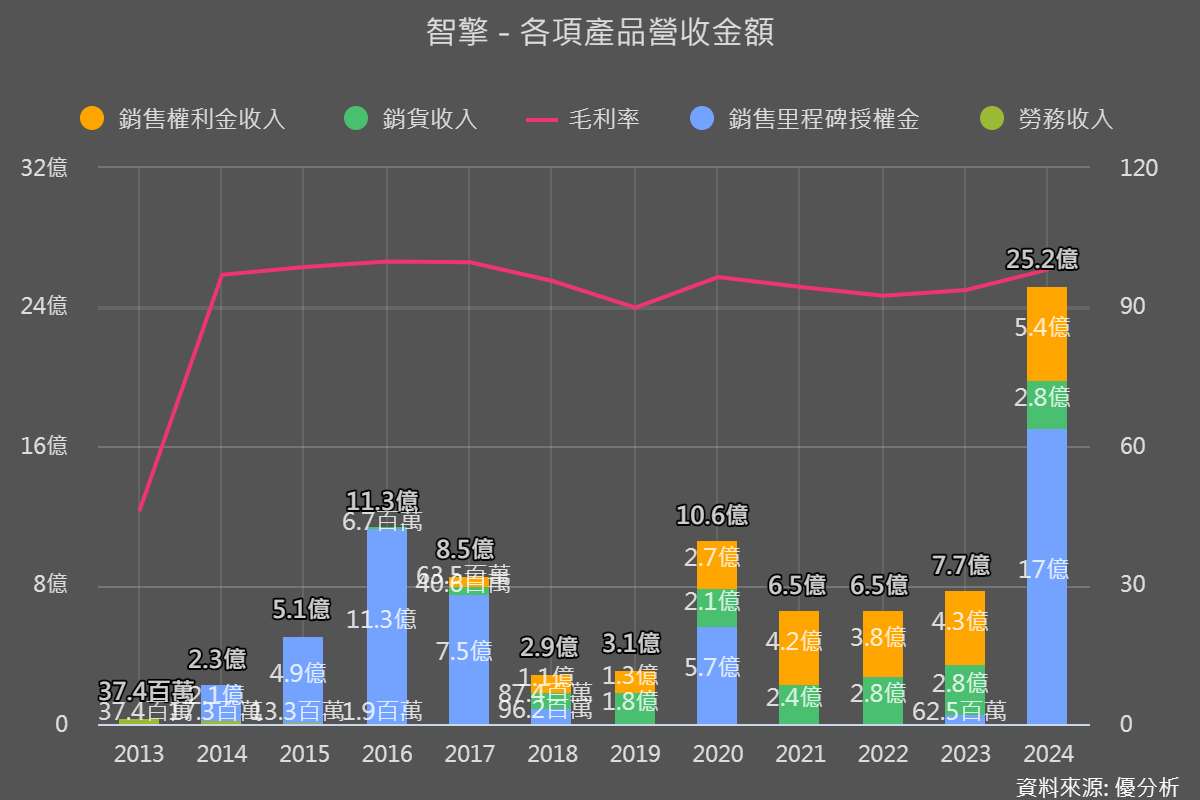
安能得一線適應症擴展,成長動能還有多少?
安能得過去主打二線胰臟癌,2024 年陸續取得美國、歐洲、台灣等地一線適應症藥證,這對公司來說是個重要里程碑。
全球 40 國上市,專利到 2032 年,市場基礎穩固。隨著一線適應症的開放,治療週期從 12 針拉長到 32 針,理論上營收有機會放大 1~2 倍。歐洲、日本、中國等地銷售權利金持續成長,2025 年預估歐亞市場權利金年增 15~20%,台灣地區營收也有望因健保給付申請通過而小幅成長。中國市場若能順利納入醫保,將是額外的成長催化劑。安能得一線適應症擴展,帶動全球市場滲透率提升。
新藥研發進度與未來布局
公司將研發重心轉向自有新藥 PEP07、PEP08。PEP07 屬於 DNA 修復藥物,臨床一期已在台灣、澳洲展開,預計 2025 年完成血液腫瘤收案,實體腫瘤則預計 2026 年完成。PEP08 則是第二代 PRMT5 抑制劑,針對 MTAP 缺失癌症細胞,動物實驗顯示合併 PEP07 使用時對腦癌有顯著療效。這兩條產品線若能順利推進,將是公司未來3~5年的成長關鍵。
不過,臨床試驗的不確定性高,且短期內難以貢獻營收,投資人需有耐心等待,未來若PEP07、PEP08 臨床進展順利,未來成長潛力可期。