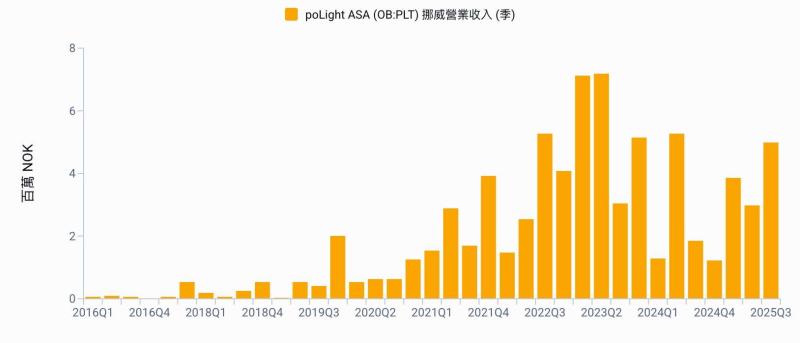
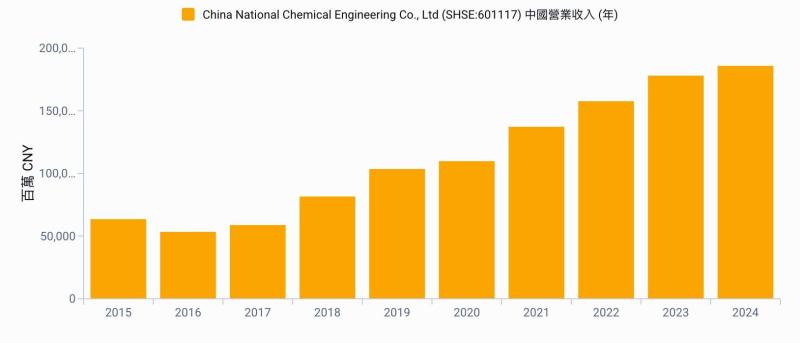
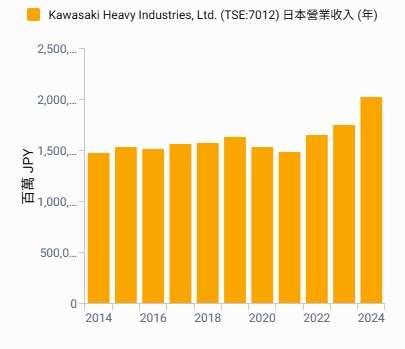
麗寶新藥 (7888-TW) 今 (28) 日舉辦興櫃前法說會,將於 23 日登錄興櫃。麗寶新藥表示,將以核心開發中新藥 LIB-101 為基礎,推動包括 HSARS 有望優先取證、CTCL 與 DLBCL 具高毛利與授權價值,以及實體腫瘤合併療法等三大動能驅動成長。
麗寶新藥指出,IL-12(介白素 - 12) 為人體天然免疫調節蛋白,兼具免疫活化、調節與組織修復功能,為目前全球免疫療法的重要技術方向,不過早期 IL-12 藥物因高毒性與半衰期短等挑戰,開發進展長期受限。
總經理劉朝瀚表示,麗寶新藥 first-in-class 研發策略重新設計 IL-12 分子,使 LIB-101 能在低劑量皮下注射,即產生免疫活性,避免傳統 IL-12 的不良反應,LIB-101 除可解決毒性問題,具備可成藥性的免疫新藥。
劉朝瀚指出,麗寶新藥以「戰備防護、罕病腫瘤、多適應症」三階段推動研發藍圖。第一階段推進的核心適應症為造血相關急性輻射症候群 (HSARS),且因全球地緣政治風險與核能使用增加所帶來的輻射風險,採購渠道包括政府及核電廠,HSARS 最快於 2 年內提出藥證申請。
有望成爲最早取得藥並商品化的市場。
第二階段為腫瘤治療領域,麗寶新藥以皮膚 T 細胞淋巴瘤 (CTCL) 作為首個切入市場的罕見癌症適應症。LIB-101 於該適應症已取得美國 FDA 與歐盟 EMA 的孤兒藥資格,預計 2026 年啟動全球臨床 2b/3 期試驗,若成功上市可望享有 7 至 10 年的市場獨占期。此外,另一罕病適應症瀰漫性大 B 細胞淋巴瘤 (DLBCL) 已推進至臨床二期。
第三階段聚焦多適應症的擴張,打造「一藥多適應症」的長線策略,因 LIB-101 具備「Turn Cold to Hot」免疫啟動能力,有望提升現有免疫療法,如 PD-1、CAR-T 的反應力,未來在實體腫瘤合併療法中具備市場潛力。
劉朝瀚提到,麗寶新藥以 first-in-class 技術為核心,並布局「國防醫療」與「免疫療法」雙主軸策略,他並指出,2026 年將啟動多項後期臨床試驗,並持續推動 IPO 計畫。
※ 本文經「鉅亨網」授權轉載,原文出處