藥華藥 (6446-TW) 於美國時間 2025 年 10 月 30 日完成向美國 FDA 提交旗下新藥 Ropeg 新增適應證申請,用於原發性血小板過多症 (ET)。藥華藥今 (30) 日公告,該申請正式進入實質審查階段。
藥華藥指出,自 10 月 30 日提出新增適應症申請後,於 12 月 8 日完成 FDA 的送件說明會議 (AOM)。並依照 FDA 於 11 月 5 日函文通知,因 FDA 在收件後 60 日內未提出其他意見,依美國聯邦法規規定,正式進入實質審查階段,實際審查時間以 FDA 正式通知為準。
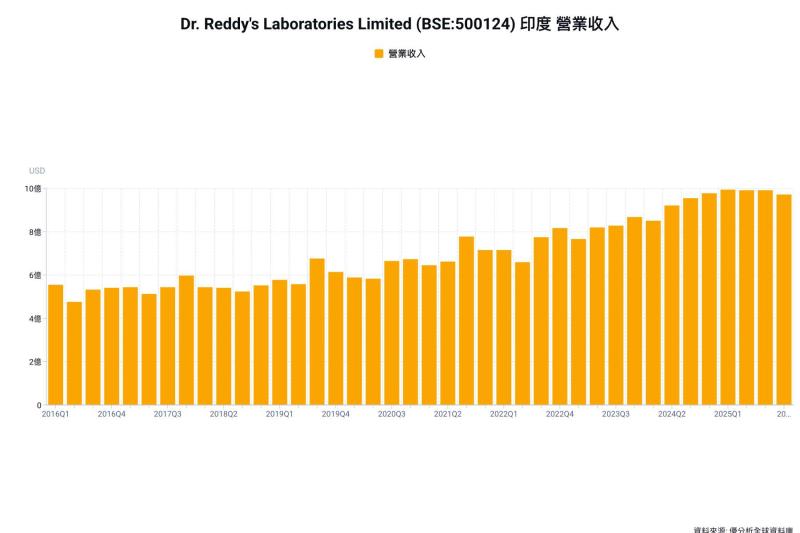
藥華藥指出,預計 2026 年可取得美國 ET 藥證,以搶攻美國 15 萬 ET 患者市場,有望成為藥華藥第二成長引擎。
至於市場現況,ET 為骨髓增生性腫瘤 (MPN) 疾病的一種,病人數與真性紅血球增多症 (PV) 的病人數相近。根據市場研究,每 10 萬人中約有 38 至 57 名 ET 患者,目前 ET 的第一線用藥是仿單標示外的愛治 (HU),第二線用藥則是安閣靈 (Anagrelide),此藥為美國 FDA 於 1997 年核准。
※ 本文經「鉅亨網」授權轉載,原文出處