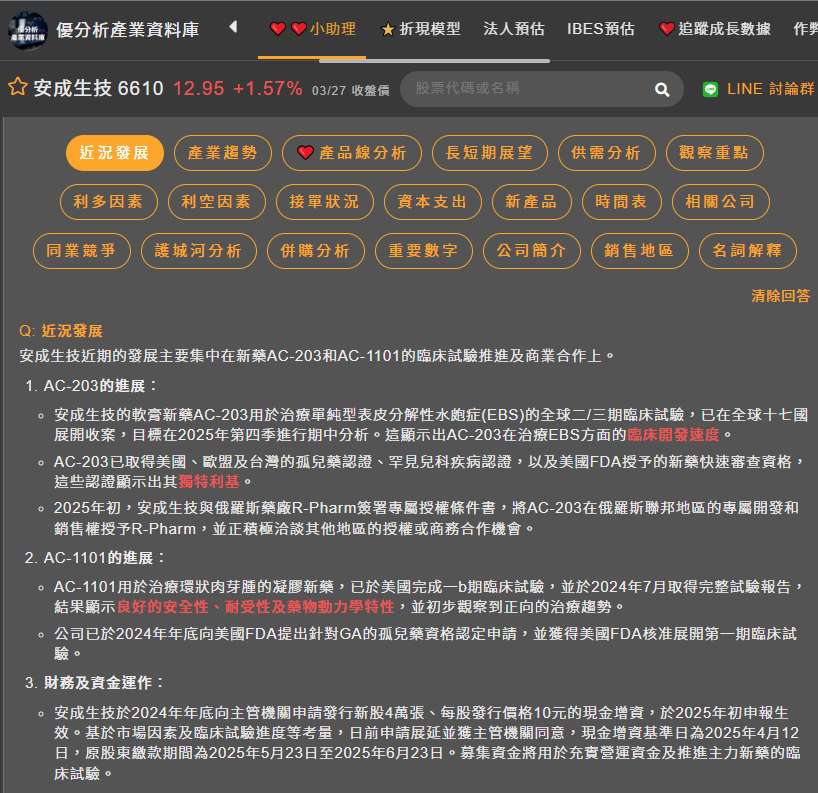
安成生技(6610-TW) 旗下治療單純型表皮分解性水皰症(EBS)的新藥AC-203,其全球二/三期臨床試驗的期中分析預計在2025年第四季進行。這項於全球17國進行的關鍵試驗,其結果將是AC-203後續開發與商業價值的關鍵指標。
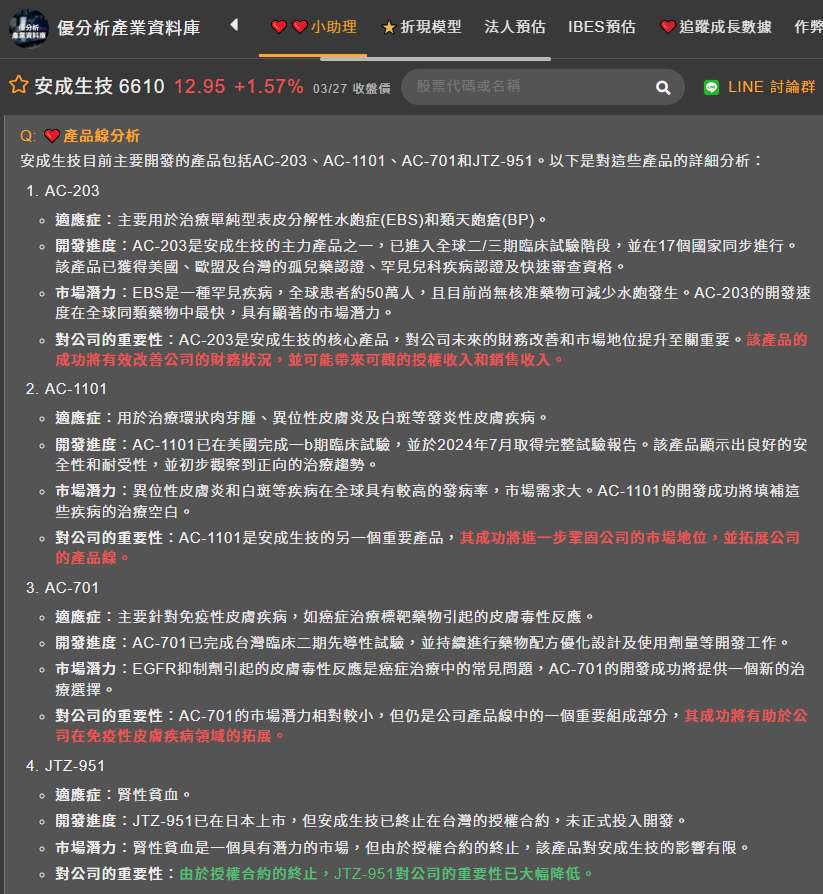
目前安成生技(6610-TW)的研發重點集中在皮膚疾病領域,其中又以AC-203最受矚目。
AC-203用於治療單純型表皮分解性水皰症(EBS)。公司策略為加速AC-203的開發進程,並積極尋求授權及商業化機會,例如已與俄羅斯藥廠R-Pharm簽署AC-203在俄羅斯聯邦地區的獨家開發和銷售權授權意向書。
(資料來源:優分析產業資料庫)
AC-203臨床試驗進展與期中分析的重要性
AC-203作為安成生技(6610-TW)的核心產品,其臨床試驗的進展備受關注。該藥物目前正進行全球多國多中心二/三期臨床試驗,涵蓋美國、台灣、澳洲、菲律賓、英國、義大利、奧地利、波蘭、馬來西亞、以色列、韓國、法國、希臘、阿拉伯聯合大公國、比利時、愛爾蘭、西班牙等17個國家,預計收納80至100位病患。
而即將到來的期中分析,將初步評估AC-203的潛力,對其未來的開發至關重要。
AC-203主要用於治療單純型表皮分解性水皰症(EBS),這是一種罕見的遺傳性疾病,患者皮膚極易產生水皰。
期中分析將對已收集的數據進行初步評估,以檢視藥物的安全性及療效,並判斷試驗是否能持續進行至最終分析。若期中分析結果正面,將為AC-203的開發提供有力支持,加速其上市進程。
EBS市場潛力與AC-203的競爭優勢
單純型表皮分解性水皰症(EBS)是一種罕見的遺傳性疾病,目前尚無核准藥物可減少水皰發生。AC-203是目前全球治療EBS藥物中,臨床開發速度最快的候選新藥。此藥已取得美國、歐盟及台灣的孤兒藥認證(ODD)及美國罕見兒科疾病認證(RPDD),並獲得美國FDA授予的新藥快速審查資格。
這些認證不僅能加速藥物審查流程,且通常享有市場獨佔權等優惠,例如美國的孤兒藥享有七年市場獨佔期,有助於AC-203在EBS市場中取得競爭優勢。
(資料來源:優分析產業資料庫)
EBS治療市場現況:未滿足的醫療需求催生龐大商機
表皮分解性水皰症(EBS)是一種罕見的遺傳性疾病,目前尚無獲批准的藥物可有效減少水皰發生。
安成生技鎖定此醫療缺口,開發AC-203,使其成為全球EBS藥物開發中臨床進度領先的候選新藥之一。AC-203已獲得美國、歐盟及台灣的孤兒藥認證(ODD),以及美國罕見兒科疾病認證(RPDD)和FDA快速審查資格,顯示其在EBS治療領域的獨特性與潛力。
孤兒藥認證(ODD)能為藥廠帶來研發補助、加速審查、市場獨佔期等多項優惠,有助於降低開發風險、加速產品上市。
現金增資與研發動能
安成生技(6610-TW)於2024年底申請現金增資,預計募集4億元資金,並擬於6/30完成募集,用於充實營運資金及推進AC-203等主力新藥的臨床試驗。
本次增資反映公司對AC-203未來發展的信心,並為其臨床試驗提供了必要的資金支持。